Forskning i medicin
Rundt omkring i verden forskes der intensivt i at finde behandlinger, der enten kan bremse eller vende udviklingen af muskelsvindsygdomme. For nogle diagnoser er forskningen langt fremme, for andre tager det længere tid.
RCFM følger den internationale forskning i medicin mod muskelsvind. Vi forsker ikke selv i medicin, men leverer bl.a. viden om sygdommenes naturlige udvikling.
Her kan du bl.a. læse om forskningsprocessen, hvilke muligheder der er for at angribe sygdommene og få et overblik over de forsøg, der er længst fremme.
Forskningsprocessen fra mus til mennesker – hvorfor tager det så lang tid
Der forskes som aldrig før for at finde medicin, der kan helbrede eller mindske symptomerne på muskelsvind, og der er virkelig sket mange fremskridt de seneste år. I dag (2019) behandler man fx Duchennes muskeldystrofi med Prednison, Spinal muskelatrofi med Spinraza, Evrysdi og Zolgensma, Myasthenia gravis med Mestinon og Pompes sygdom med Myozone.
Ingen af disse mediciner helbreder, men de mindsker symptomer og gavner livskvalitet, og i heldigste fald øger de overlevelsen.
Der er endnu ikke så mange forskellige slags medicin på markedet, men der er mange forsøg med udvikling af ny medicin i støbeskeen, og det accelererer hele tiden. Mange (men ikke alle) af forsøgene ender med nye medicinske præparater, men det går langsomt. Det er ikke usædvanligt, at det tager mere end 15 år, fra man begynder sine forsøg, til en ny medicin kan sælges på apoteket.
Forsøg i laboratoriet og i klinikken
Udviklingen af medicin falder i to dele: De førkliniske undersøgelser og de kliniske undersøgelser. De førkliniske undersøgelser foregår i et laboratorium og omfatter kemiske forsøg, afprøvninger på celleniveau og som regel også dyreforsøg (fx på mus). Ved de kliniske undersøgelser afprøver man det udviklede medikament på mennesker.
”
Medicin til sjældne sygdomme kaldes orphan drugs
Ved sjældne sygdomme er der kun udsigt til at kunne sælge en mindre mængde medicin, mens udviklingsomkostningerne kan være lige så store som ved at lave medicin til store befolkningsgrupper. Dermed er medicinalvirksomhedens mulighed for at tjene penge på medicinen dårlig og incitamentet til at lave sjælden medicin begrænset.
Særlige regler for medicin til sjældne sygdomme
For at rette op på denne situation har man i USA og i EU lavet særlige regler for udviklingen af medicin til meget sjældne sygdomme. De kaldes ”orphan drugs” og man støtter produktionen af dem ved at give de medicinalfirmaer, der arbejder med dem nogle fordele frem for, hvad der ellers er normalt ved udvikling af ny medicin. Det drejer sig blandt andet om skattefordele, lempeligere vilkår vedrørende tidsfrister og hurtigere sagsbehandling ved ansøgning om fx markedsføringstilladelse.
Hvis den nye medicin skal gives mod meget alvorlige sygdomme, hvor der ikke allerede findes en virksom medicin, og hvor sygdommen medfører døden eller meget alvorlige symptomer, kan myndighederne (i EU og USA) give en såkaldt ”Fast Track” tilladelse, der ligesom ”orphan drug” tilladelsen gør det muligt at udvikle den nye medicin hurtigere og billigere.
Førkliniske undersøgelser
Er det sikkert? Har det en effekt? Kan det bevæge sig til den del af kroppen, der har brug for det? Er det stabilt? Hvad sker der med medikamentet, når det bliver nedbrudt? Bliver det til noget giftigt? Hvordan reagerer kroppen, når den får medikamentet?
Disse spørgsmål bliver stillet og besvaret igen og igen, om de substanser forskerne udvikler med det mål, at det kan blive til medicin. For hver runde spørgsmål og svar prøver man at gøre medikamentet bedre og starter så forfra med undersøgelserne, til man til sidst står med et, måske flere, lovende medikamenter.
Næste skridt er at afklare hvilken metode til at give medikamentet til mennesker, der er den bedste. Man kan tage en pille, give medikamentet intravenøst eller subkutant. Man kan også indsprøjte medikamentet direkte i den eller de muskler, man vil behandle. Man skal også forsøge at finde ud af, i hvor store doser medicinen skal gives for at have en effekt.
Det er også vigtigt, at afklare om man kan fremstille medicinen, så den er helt ens ved hver produktionsrunde. Og man skal finde ud af, om man kan lave medicinen i store nok portioner, til at de kan opfylde behovene hos patienterne. Nogle medikamenter er enkle at lave, mens andre, fx biologiske medikamenter, er meget komplicerede og tilsvarende vanskelige og kostbare at fremstille.
På baggrund af resultaterne fra den førkliniske undersøgelse kan man søge myndighederne om tilladelse til at afprøve medikamentet på mennesker i den kliniske undersøgelse.
Kliniske undersøgelser
Ved de kliniske undersøgelser bliver medikamentet for første gang afprøvet på mennesker. Ligesom ved de førkliniske undersøgelser er målet at afklare, i hvor store doser præparatet skal gives til, at der er en behandlingsmæssig effekt og færrest mulig bivirkninger. Det skal også afklares, hvordan man skal give medicinen og hvor ofte. Det er mange af de samme spørgsmål, man stillede i de førkliniske undersøgelser, men der er en afgørende forskel på at undersøge laboratoriemus og på at undersøge mennesker.
Der er ofte mange, der gerne vil deltage som forsøgsperson i et håb om, at de kan afprøve en behandling, der har en god effekt. Men målet med den kliniske undersøgelse er ikke at behandle.
Får jeg medicin eller placebo?
Er man forsøgsperson i et forskningsprojekt, kan man risikere, at det medikament man undersøger, ikke har en gunstig effekt. Der er også en mulighed for, at man som forsøgsperson deltager i undersøgelsen ved at få placebo (snydemedicin). Og hvis man får et virksomt præparat, er der ingen sikkerhed for, at man kan fortsætte med at få det, efter forsøget er slut.
Viden om naturhistorien er vigtig
”
RCFM deltager også i den medicinske forskning ved at levere viden om sygdommenes naturlig forløb
Før man kan gå videre med forsøgene, er man nødt til så detaljeret som muligt at vide, hvordan den naturlige udvikling for en person med den aktuelle sygdom er. Man må vide, hvordan den ubehandlede sygdom forløber, før man kan se om medikamentet medfører en forskel. Forskning i sygdommenes forløb udføres ikke kun af de, der udvikler medicin, men foretages løbende af forskere verden over.
Det er ikke Rehabiliteringscenter for Muskelsvinds formål at udvikle medicin, men alligevel bidrager centret til processen, fortæller fysioterapeut, ph.d. Ulla Werlauff fra Udviklingscentret (UC). Udover at følge med i hvad der sker på den internationale scene, så har centret tidligere været med til at beskrive naturhistorien for bl.a. Duchennes muskeldystrofi, påpeger hun.
For at kunne beskrive en sygdoms naturhistorie må man have nogle instrumenter til at kunne måle den, det drejer sig om særlige målemetoder, der er udviklet specielt til en snæver problemstilling (der dog godt kan gå igen ved mange forskellige sygdomme).
Udviklingscentret har løbende deltaget i arbejdet med udvikling af målemetoder, fortæller Ulla Werlauff. Fx blev EK skalaen til klassifikation af funktionsevne ved Duchennes muskeldystrofi (DMD) udviklet af Birgit Steffensen fra UC. EK skalaen har fået stor international anerkendelse. For øjeblikket medvirker UC i et internationalt projekt, der skal udvikle et måleredskab for armfunktion hos mennesker med DMD, siger Ulla Werlauff.
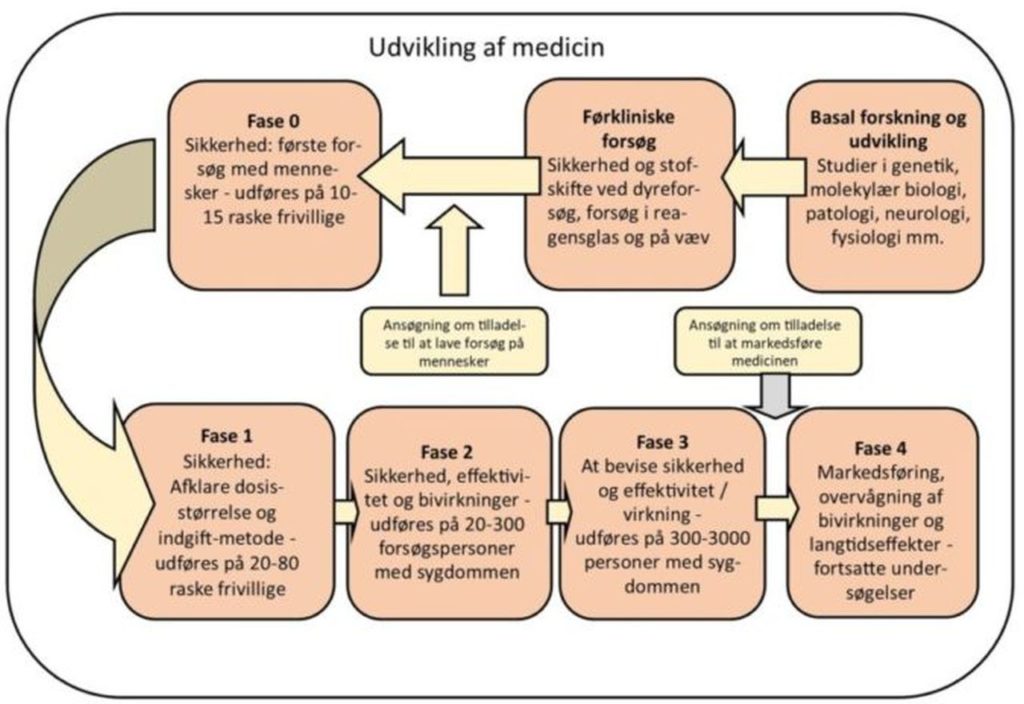
De fire faser i kliniske forsøg
Når medicinen endelig er nået så langt, at den kan testes på mennesker, skal den igennem mindst tre faser, før man kan søge om godkendelse.
I fase 0 gennemføres de første forsøg på mennesker. Man giver kun medikamentet i meget små doser – langt under, hvad man tror, kan have en effekt. Kun 10-15 personer uden sygdom deltager i denne fase, der først og fremmest handler om at fastslå, hvor sikkert præparatet er, og hvordan det absorberes, fordeler sig, omsættes og nedbrydes i kroppen.
I fase 1 undersøger man på en lille gruppe mennesker (20-80), hvor store doser det kan være sikkert at give forsøgspersoner, og man begynder at vurdere bivirkningerne.
I fase 2 prøver man for første gang at give medikamentet til mennesker, der har den sygdom, man vil behandle. Man undersøger en middelstor gruppe personer (20-300) for at se, hvor effektivt medikamentet er til at behandle sygdommen, og om effekten afhænger af dosernes størrelse eller den måde, de gives på. Også i fase 2 er der stor fokus på bivirkningerne.
I fase 3 undersøger man på en meget stor gruppe personer med den sygdom, man vil behandle (300-3000), hvordan medikamentet virker som behandling, og hvilke bivirkninger det har. Det store antal forsøgspersoner betyder, at det er meget omfattende at gennemføre denne fase.
Muskelsvind er sjældne sygdomme, og det er kun store lande, der selv kan finde det store antal forsøgspersoner, der er brug for i fase 2 og fase 3. Derfor er det almindeligt, at forskellige forskningscentre over hele verden samarbejder om at afprøve medicinen.
I fase 2 og fase 3 gennemføres undersøgelserne ofte ved, at man inddeler forsøgspersonerne i flere forskellige grupper. I nogle grupper får forsøgspersonerne en dosis forsøgsmedicin, i en anden gruppe, en anden dosis, og som regel er der også en gruppe, der får uvirksom medicin, det såkaldte placebo. Mens forsøget foregår, ved hverken forskere eller forsøgspersoner, hvem der får hvad. Det opgøres først til sidst. Forsøgspersonerne bliver jævnligt undersøgt for ændringer i deres tilstand.
Bivirkningerne vurderer man løbende, og hvis de er for voldsomme eller for mange, kan en forsøgsperson trække sig, eller forsøget kan standses.
Ved afslutningen af forsøget må man vurdere, om der er et fornuftigt forhold mellem virkninger og bivirkninger. Hvis resultaterne har være gode og bivirkningerne små, er der basis for at søge myndighederne om tilladelse til at markedsføre den nye medicin.
Fase 4
Efter medicinen er blevet markedsført, bliver man ved med at undersøge langtidsvirkningerne og bivirkningerne. Dette forløb omtales som fase 4.
Forskningsoverblik
Herunder kan du læse om forskning i medicin til forskellige muskelsvinddiagnoser.
Ikke alle diagnoser er repræsenteret, men der er rigtig mange forsøg i gang verden over med medicin til andre diagnoser også. Her har vi valgt kun at beskrive mulige behandlinger, der er så langt, at de bliver testet på mennesker i fase 2 og 3.
-
Skyclarys (omaveloxolone) er udviklet af medicinalvirksomheden Biogen og er godkendt af det europæiske medicinråd EMA.
Skyclarys virker ved at bekæmpe oxidativ stress, en tilstand, der kan opstå, når der er for mange frie radikaler i kroppen og ikke nok antioxidanter til at slippe af med dem, hvilket kan føre til celle- og vævsskader.
Omaveloxolone, som, sælges under navnet Skyclarys kan forsinke sygdommens udvikling, målt ved Modified Friedreich’s Ataxia Rating Scale (mFARS), sammenlignet med rehabiliterende behandling, men det er usikkert, hvor længe effekten af behandlingen varer ved, og hvor meget livskvaliteten forbedres. Lægemidlet er ikke undersøgt i forhold til overlevelse eller følgesygdomme.
Medicinen indtages gennem munden i pilleform. De mest almindelige bivirkninger ved inkluderer hovedpine, kvalme, træthed og mavesmerter. Disse bivirkninger er generelt milde til moderate i alvorlighed.
Omkostningerne ved behandlingen er meget høje, og Medicinrådet har vurderet, at de er urimeligt høje i forhold til effekten, selv når alvorlighedsprincippet tages i betragtning, og derfor kan de ikke anbefale Skyclarys som standardbehandling.
Forskning i forskellige metoder til behandling af muskelsvindsygdomme
Forskning i genterapi
Genterapi er en behandlingsform, hvor man overfører genetisk information til celler i patienter, i forsøget på at erstatte eller reparere defekte gener hos mennesker med arvelige sygdomme.
I denne video kan du høre professor i personlig medicin Jacob Giehm Mikkelsen fortælle om forskning i genterapi. Filmen er produceret af SundhedsTV.
Forskning i behandling med stamceller
Nogle celletyper i vores organisme bliver hyppigere nedbrudt end andre og kan også lettere erstattes. Dette gælder f.eks. hudceller og celler i vores slimhinder, men det forholder sig anderledes med nerveceller, der er dannet og udvokset i forstertilstanden og barnealderen.
Når kroppen skal erstatte ødelagte celler, benytter den sig af sine stamceller. Stamceller er nogle særlige celler, der er placeret overalt i kroppen. De har den egenskab, at de kan dele sig og udvikle sig til andre celletyper og til en vis grad gendanne nye stamceller. Derved kan stamceller reparere og gendanne ellers ødelagt væv.
Pluripoente eller unipotente celler
Man kan inddele stamceller i den type der findes i fostertilstanden, hvor de kan blive ophav til mange forskellige celler (pluripotente) og så stamceller (unipotente) hos voksne, der kun kan blive til celler af en bestemt type, hvis forholdene ellers tillader det.
Et eksempel
En voksen person har en motorisk nervecelle i rygmarven, der sender en nerveudløber på måske 90 cm. ud til en muskel i foden. Hvis man forestillede sig, at man forstørrede denne nervecelle til en størrelse som en appelsin, så ville den tilsvarende udløber få en længde på flere kilometer.
Hvis en sådan motorisk nervecelle bliver beskadiget og ophører med at fungere, kan den umiddelbart ikke erstattes af en nydannet nervecelle. Men organismen har en stor reservekapacitet, således at en anden eller andre nerveceller overtager den ikke-fungerendes funktion ved at sende udløbere hen, hvor de mangler. Dette kan ske indtil en kritisk grænse, hvor reservekapaciteten er opbrugt, hvorefter antallet af fungerende nerveceller kommer under en grænse, således at musklerne i arme og ben ikke får de elektriske impulser, de har brug for, og dermed udvikles muskelsvind.
På nuværende tidspunkt findes der ikke videnskabeligt belæg for, at sådanne systemer med motoriske nerveceller kan erstattes. Selv ikke med de allerbedste transplantationsmetoder – og selv ikke med stamceller uden ændringer i arveanlæggene.
I denne forbindelse skal nævnes, at svenske forskere som de første i 1984 begyndte at transplantere specielle stamceller til patienter med Parkinsons sygdom. Parkinson-patienterne mangler nogle dopaminproducerende nerveceller. Nu mange år efter har man endnu ikke kunnet udvikle dette transplantationskoncept til en behandling, der fungerer.

Muskelceller nedbrydes og gendannes af muskelstamceller
Det forholder sig i princippet lidt anderledes med muskelceller eller myocytter. De er langstrakte celler, der oprindelig består af flere celler, hvorfor der er flere cellerkerner i en muskelcelle. Ny muskelceller kan gendannes eller repareres af myoblaster, som er muskelstamceller.
Hos personer med muskelsvindssygdomme, fx Duchennes muskeldystrofi, sker der, i forhold til raske, en meget hurtig nedbrydning af muskelcellerne. Det sker pga. af en ændring og dermed fejlfunktion af muskelproteinstoffet dystrofin. Ligesom hos raske personer bliver de nedbrudte muskelceller hos Duchenne-drenge gendannet af muskelstamceller. Men de nydannede muskelceller mangler også dystrofin og fungerer derfor ikke optimalt. Desuden er der en øvre grænse for, hvor mange gange det er muligt at gendanne muskelceller. Når den grænse er nået udvikles muskelsvind. Det er således, forsimplet sagt, nedbrydningshastigheden og dermed behovet for at gendanne ødelagte muskelceller, der bestemmer hvor hurtigt kraftnedsættelsen og dermed muskelsvindet udvikler dig.
Problemet med transplatation af muskelstamceller
I princippet kan man transplantere ny muskelstamceller fra raske til personer med fx Duchennes muskeldystrofi, men det skal formodentligt ske, mens der endnu ikke er sket for meget nedbrydning af musklen. Den nedbrudte muskelcelle erstattes af ar- og fedtvæv, som ikke har en god blodforsyning.
Problemet med transplantation af nye muskelstamceller er at få dem fordelt og transporteret ud til alle muskler i kroppen. Det problem har man endnu ikke løst. Fx er det sådan, at hvis det skulle have en effekt at indsprøjte nye muskelstamceller, skal der gives et meget stort antal indsprøjtninger med ca. ½-1 mm’s afstand. Det er en praktisk umulighed.
Hvor kan jeg finde mere information
RCFM følger med i forskningen, men kan ikke beskrive alle de forsøg, der er i gang verden over. Hvis du ønsker et overblik over alle igangværende forsøg og forskningsprojekter, kan du besøge siden clinicaltrials.gov, hvor du kan søge på forskellige diagnoser eller præparater.
TREAT-NMD er et internationalt netværk for forskning i muskelsvind. På deres hjemmeside kan man læse om, hvad der foregå både i den førkliniske (preclinical) og kliniske forskning (clinical).
Neurologisk tidsskrift er et dansk onlinemedie, som skriver om forskning og behandling af neurologiske sygdomme, herunder muskelsvind. Det er muligt at abonnere på deres nyhedsbrev. Her kan du læse et temanummer om genterapi, som bl.a. handler om medicin til SMA.