Oversigt over forskning i medicin til SMA
Nedenfor kan du læse om de genetiske årsager til SMA, og hvordan man forsøger at korrigere dem ved hjælp af forskellige typer medicin. Du får også en oversigt over medicintyper og igangværende forsøg.
Så længe årsagen til SMA har været kendt, har der været forsket i at finde en medicinsk behandling mod sygdommen. I mange år gik forskningen langsomt, og de fleste produkter nåede aldrig længere end til laboratorierne.
I 2016 skete der imidlertid et gennembrud i forskningen, som gav familier og personer med SMA håb om, at der endelig var en behandling på vej. I dag findes der tre godkendte behandlinger i Europa, Spinraza, Zolgensma og Evrysdi, og der er flere forsøg i gang verden over med nye præparater.
Viden om forskning
I RCFM møder vi personer og familier med SMA , som gerne vil holde sig opdateret på den nyeste forskning i behandlinger til SMA. Der er rigtig meget information at finde, men det meste er på engelsk, og det kan være svært at vurdere, hvor veldokumenteret denne information er.
Denne oversigt er vores forsøg på at give et overblik over de eksisterende lægemidler på markedet og de lægemidler, der forskes i lige nu. I oversigten kan du også læse om, hvilke kriterier, præparater til SMA vurderes og godkendes efter, inden de kan tages i brug til behandling.
Det videnskabelige felt inden for behandling af SMA er kæmpestort og i hastig udvikling, og det er derfor umuligt at beskrive alle forskningsprojekter i en kort oversigt. Derfor beskrives kun forsøg med lægemidler, der er i den fase af forskningen, hvor de afprøves på mennesker, og for hvilke der findes offentliggjorte forskningsresultater.
RCFM følger udviklingen tæt, og oversigten vil derfor blive opdateret løbende. Seneste opdatering er fra februar 2023.
Årsagen til SMA og hvordan den angribes
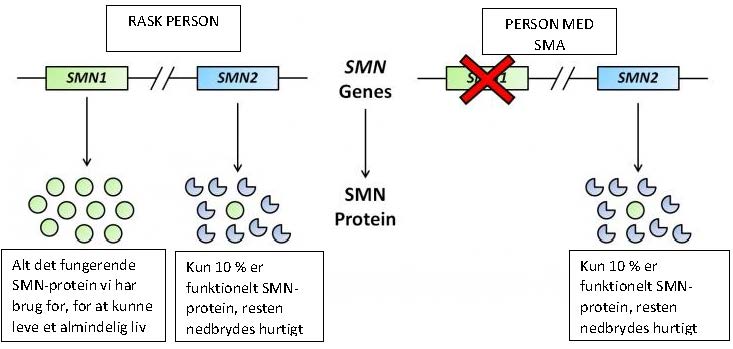 Lige nu forskes der i at angribe SMA på fire forskellige måder:
Lige nu forskes der i at angribe SMA på fire forskellige måder: Ved at erstatte eller korrigere det defekte SMN1-gen
Når man vil erstatte et defekt gen med et raskt hos en person med SMA, indføres en funktionsdygtig kopi af SMN1-genet i cellekernen, som derefter kan producere normalt SMN-protein. Det er ikke muligt at indføre genet direkte i cellen, så man bliver nødt til at anvende en såkaldt vektor til at få genet derind. En vektor er en virus, der er modificeret, så den ikke gør folk syge, men som kan bruges til at ”inficere” cellen med det nye DNA.
Denne metode anvendes bl.a. i behandlingen Zolgensma som er udviklet af firmaet Novartis.
Ved at forbedre det dårligere fungerende SMN2 back-up-gen
Der findes en næsten identisk kopi af SMN1-genet kaldet SMN-2. Meget tyder på, at jo flere SMN2-kopier man har, jo mildere er sygdommen. Problemet er, at SMN-2-genet kun danner en lille smule af det funktionelle SMN-protein, Derfor forsøger forskere på forskellige vis at forbedre SMN2-genet, så det enten er i stand til at producere et helt protein, producere mere protein eller producere protein, der holder bedre.
Dette kan fx gøres ved hjælp af specialdesignede små molekyler kaldet antisenseoligonukleotider (ASO). Denne teknik anvendes i fx Spinraza.
Små molekyler
Forskerne arbejder også med at screene hundredetusindevis af andre specialdesignede små molekyler for at finde ud af, om nogle af dem kunne bruges i medicin, der giver et bedre fungerende SMN2-gen. Eksemp0ler på sådanne små molekyler, der kan anvendes som medicin, er Evrysdi, der fører til korrekt splejsning og dermed øger proteinniveauet.
Ved at beskytte musklerne for at forhindre tab af muskelkraft eller genoprette muskelkraften
Motorneuroner er en særlig type nerveceller, som dør, når man har SMA. Motorneuronerne er de tråde, der forbinder hjernen og rygmarven med musklerne, og når de dør, medfører det tab af muskelkraft og paralyse af musklerne. Forskere arbejder med en metode til at beskytte musklerne fra at blive paralyserede og øge deres styrke. Metoden reparerer ikke den genetiske fejl, men kan godt anvendes sammen med de behandlingsformer, som forsøger at styrke SMN-generne.
Metoden anvendes af firmaet Cytokinetics, som arbejder på at udvikle behandlingen Reldesemtiv, der øger musklernes evne til at trække sig sammen, og derved forbedre muskelstyrke og funktionsevne. Medicinen er tænkt til at kunne bruges i kombination med fx Spinraza, som en booster til at genoprette den tabte muskelkraft.
Ved at beskytte de motorneuroner, der er påvirkede af tabet af SMN-protein
I stedet for at beskytte musklerne, kan man også forsøge at forhindre, at motorneuronerne dør. Der er i øjeblikket ikke igangværende forsøg med denne metode.
Oversigt over behandlinger, der anvender de forskellige metoder
Nedenstående tabel viser, hvilke typer medicin – godkendte eller under udvikling – der anvender de forskellige metoder.
| Erstatte SMN1-genet | Optimere SMN2-genet | Beskytte motorneuroner | Beskytte musklerne |
| Zolgensma (Novartis) Godkendt | Spinraza (Biogen) Godkendt | Apitegromab (Scholar Rock) Fase 3 | |
| Evrysdi (Risdiplam, Roche) Godkendt | NMD670 (NMD Pharma) Fase 2 | ||
| Taldefgrobep Alfa (Biohaven) Fase 3 |
Hvad undersøger man i kliniske forsøg?
Om effektmål
Før man igangsætter et klinisk forsøg på mennesker, er det vigtigt at definere, hvad man ønsker forsøget skal vise noget om. I forsøg med personer med SMA kan de fx være mål om overlevelse, bedre vejrtrækningsfunktion, motorisk udvikling, bivirkninger og livskvalitet.
WHO har defineret seks grundliggende milepæle for motorisk udvikling, som studier på børn med SMA ofte refererer til. Disse er at: sidde selv, stå med støtte, kravle, gå med støtte, stå selv, gå selv.
Der findes en række standardiserede metoder og skalaer til at måle virkningen af en behandling. For at kunne sammenligne forskellige kliniske forsøg er det vigtigt, at man bruger de samme måleredskaber, og at de personer, der foretager målingerne, er uddannede i at bruge dem.
Ved behandling af børn med SMA anvendes metoderne CHOP INTEND (Children’s hospital of Philadelphia infant test of neuromuscular disorders) og Hammersmith functional motor scale expanded (HFMSE). Med disse metoder, kan man måle om der er sket ændringer i funktionsniveauet.
Signifikans
Det er også typisk de to metoder, der anvendes ved kliniske forsøg, til at måle om et resultat af et studie er signifikant. Dette gøres ved at vurdere forskellen mellem behandlet gruppe og ikke behandlet gruppe. Det er ikke tilstrækkeligt at der er en forskel; forskellen skal være signifikant. Dette betyder at forskellen skal være så stor, at den skyldes andet end den tilfældige variation, som altid vil være der.
Godkendelse til markedsføring
Det er resultaterne af de kliniske forsøg, der afgør, om en medicinsk behandling bliver godkendt til markedsføring af myndighederne. Medicinalvirksomheder, som ønsker at markedsføre et nyt lægemiddel i Europa, skal først søge om godkendelse til markedsføring hos Det Europæiske Lægemiddelagentur (EMA).
Hvis EMA godkender et nyt lægemiddel, er det op til de enkelte landes egne myndigheder at bestemme, om det skal anvendes i det pågældende land. I Danmark er det Medicinrådet, der vurderer, om nye lægemidler og nye indikationer kan anbefales som mulig standardbehandling, og som udarbejder fælles regionale behandlingsvejledninger.
Både EMA’s og Medicinrådets vurderinger foretages på baggrund af resultaterne af de kliniske forsøg.
For at blive godkendt som standardbehandling skal Medicinrådet vurdere, at der er tilstrækkelig evidens for, at et lægemiddel har klinisk merværdi sammenlignet med placebo. Evidens betyder, at der er ført videnskabeligt bevis for, at noget virker.
Igangværende forsøg
Forskere og klinikere arbejder konstant på at udvikle nye behandlinger til SMA. Herunder finder du en beskrivelse af de igangværende forsøg med medicin.
-
Dansk udviklet lægemiddel
NMD670 er et nyt lægemiddel baseret på små molekyler, som er udviklet af den Aarhus-baserede medicinalvirksomhed NMD Pharma.
NMD670 er et molekyle, der styrker musklernes evne til at trække sig sammen. Det gør det ved at blokere en kanal, der transporterer klorid ind i muskelcellerne og får musklerne til at slappe af. Ved at blokere kloridkanalen håber man at kunne øge musklernes styrke og funktion.
Metoden kan være nøglen til at udvikle behandlinger til andre neuromuskulære sygdomme, og NMD Pharma afprøver også medicinen på personer med myastenia gravis og CMT.
Fase 2-forsøg for gående patienter med SMA 3
I slutningen af september 2023 fik den første patient med SMA en dosis NMD670 som led i et dobbeltblindet, randomiseret, placebokontrolleret fase 2-forsøg på gående patienter med SMA 3. Forsøget skal vurdere sikkerhed og virkning af medicinen samt hvordan den tolereres af forsøgspersonerne.
Forsøget er opstartet i Leuven i Belgien, men både Aarhus Universitetshospital og Rigshospitalet deltager i forsøget.
Læs mere om forsøget på Study Record | ClinicalTrials.gov
Læs mere om teknologien bag medicinen her:
Klorid-kanal i muskelceller giver ny viden om muskelsygdomme – Københavns Universitet (ku.dk)Se hvor langt man er med forsøgene i NMD Pharmas pipeline Pipeline — NMD Pharma
-
Apitegromab fra Scolar Rock og Taldefgrobep alfa fra Biohaven er begge lægemiddelkandidater, der hæmmer aktiveringen af stoffet myostatin.
Myostatin er et naturligt protein, der normalt regulerer skeletmuskelvæksten, hvilket er en vigtig proces i udviklingen af sunde muskler. Proteinet er blandt andet kendt fra køer, som har en mutation, der sætter myostatin ud af spillet, og derfor giver køerne en enorm, uhæmmet muskelvækst.

Hos patienter med neuromuskulære sygdomme kan overaktiv myostatin begrænse væksten af musklerne. Derfor forsøger man ved hjælp af medicin at hæmme aktiveringen af myostatinet.
Apitegromab
- er afprøvet på 58 personer med SMA type 2 og 3 i 52 uger
- Efter 36 måneder resulterede behandlingen i statistisk signifikante forbedringer i motorisk funktion og mobilitet.
- Effektens synes at være størst hos yngre personer, selvom potentielle beskedne effekter hos ældre personer måske ikke er blevet påvist i den forholdsvis lille pilotundersøgelse.
- En fase 3-undersøgelse (SRK-015-003/SAPPHIRE) er i gang.
Taldefgrobep alfa
- afprøves lige nu i et fase 3-forsøg med ca. 180 patienter i aldersgruppen 4-21 år fra 53 steder rundt om i verden
- Der foretages en randomiseret, placebo-kontrolleret undersøgelse på 48 uger efterfulgt af 48 uger, hvor alle får medicinen.
- I forsøget undersøges effektiviteten og sikkerheden af taldefgrobep som supplerende behandling til Spinraza, Evrysdi og Zolgensma hos deltagere med SMA.
FDA er ansøgt om godkendelse og behandler lige nu ansøgningen. Der forventes en afgørelse i 2025.
Godkendte behandlinger
I Danmark er tre lægemidler godkendt til behandling af SMA. Nedenfor gives der et overblik over resultaterne fra de kliniske forsøg med de tre lægemidler.
-
Medicinrådets anbefaling af Spinraza
Medicinrådet anbefaler Spinraza som standardbehandling til følgende grupper af patienter med SMA:
- børn med SMA 1, som ikke er i permanent respiratorbehandling
- personer med SMA type 2 og 3 mellem 6 og 17 år, som ikke er i permanent respiratorbehandling med trakeostomi eller anvender non-invasiv respirator i mindre end 16 timer pr. døgn/i mere end 21 dage
- og personer med SMA type 2 og 3 mellem 18 og 25 år, som opfylder samme kriterier som ovenfor og visse andre funktionsmæssige kriterier.
Anbefalingerne er foretaget på baggrund af resultaterne fra de kliniske forsøg med medicinen.
Medicinrådet anbefaler ikke, at Spinraza kombineres med andre lægemidler mod SMA, da der aktuelt ikke er dokumentation for bedre effekt ved at kombinere flere behandlinger. Patienter, som er i behandling med Spinraza, kan skifte til behandling med risdiplam, hvis virkning Medicinrådet sidestiller med Spinraza. Risdiplam er anbefalet som førstevalg til alle patienter, fordi det er det billigste at bruge.
Seneste nyt
FDA behandler lige nu en ansøgning om godkendelse af at bruge en højere dosis af Spinraza. Der forventes en beslutning i 2025.
Forsøg med Spinraza, der ledte frem til godkendelsen
ENDEAR studiet (SMA 1)
Dette var forsøget, der gav Biogen autorisation til at markedsføre medicinen i USA. EMA fulgte trop med en godkendelse ca. et halvt år efter i juni 2017. Forsøget, som blev udført på 122 spædbørn med SMA type 1, viste, at lidt over halvdelen af de børn, som fik medicinen, opnåede en forbedring af deres motoriske milepæle, hvorimod ingen i kontrolgruppen opnåede en forbedring.
Ligeledes var risikoen for at dø eller at skulle være afhængig af permanent respirator reduceret med 50 % hos børn, som fik behandling. Jo tidligere i forløbet, børnene fik behandlingen, jo større var deres chance for at overleve og selvstændigt at kunne trække vejret. Hos 73 % af spædbørnene kunne der måles forbedring på CHOP INTEND-skalaen.
CHERISH studiet (SMA 2)
Resultaterne fra forsøget, som evaluerede behandling med Spinraza i en periode på 15 måneder, blev offentliggjort i New England Journal of Medicine i februar 2018.
126 børn med SMA2 (i alderen 2-12-år), som kunne sidde selv, men ikke gå, deltog i forsøget. Deltagerne skulle kunne bevæge sig og måtte ikke have brug for respirationshjælp eller mavesonde eller have skoliose. Der var både en testgruppe (84 personer) og en placebogruppe (42 personer). Testgruppen fik fire injektioner Spinraza, og placebogruppen gennemgik en procedure, der efterlignede den rigtige, ved at de blev bedøvede og fik lavet et snit i ryggen, der skulle foregive injektion.
Deres motoriske udvikling blev testet med Hammersmith Functional Motor Scale – expanded.
Hovedresultat: Forskerne målte en signifikant ændring mellem den behandlede gruppe og den ikke behandlede gruppe. Der var ikke forskel på de to grupper, i forhold til om de opnåede at kunne stå alene eller gå med støtte. Dette forsøg viste, at jo tættere børnene var på diagnosetidspunktet, jo bedre udbytte havde de af medicinen.
Opfølgningsstudie på personer med SMA 2 og 3 viste, at virkningen stadig holder efter tre år
Et lille studie, der over knapt to år undersøgte langtidsvirkningerne af Spinraza-behandlingen og også inkluderede ældre personer med SMA .
I studiet deltog 28 personer, som alle havde deltaget i et tidligere studie af Spinraza. Ved begyndelsen af de første studier havde deltagerne en alder på mellem 2-15 år. Dvs. at studiet blev udført på børn, der allerede havde fået behandling med Spinraza og det siger derfor ikke noget om, hvilken virkning medicinen har på ældre børn og voksne, som aldrig har fået præparatet før.
Studiet viste, at der er en langtidseffekt af Spinraza, idet virkningen fortsætter eller som minimum vedligeholdes over tid (op til tre år). For personer med SMA II viste studiet en effekt med en stigning i armfunktion. For personer med SMA III var der også effekt på armskalaen og gangfunktionen.
Studiet har desværre nogle svagheder, hvilket betyder, at resultaterne ikke regnes for sikre, og de viser ikke noget om, hvordan resultaterne er relateret til alder.
Langtidsdata (op til ca. 5 år)
45 patienter (12–62 år) blev fulgt i gennemsnit 56,7 måneder. Resultaterne viste at, motorisk funktion og fatigue forblev stabil over tid. Stabilitet er klinisk relevant, fordi SMA, der ikke behandles, typisk forværres over tid.
Effekten var uafhængig af alder ved behandlingsstart, antal SMN2-kopier og SMA-type.
-
Markedsføringstilladelse og Medicinrådets anbefalinger
Novartis fik i slutningen af maj 2019 tilladelse til at markedsføre medicinen onasemnogene abeparvovec i USA under navnet Zolgensma. EMA godkendte medicinen til markedsføring i Europa i marts 2020.
Medicinrådet i Danmark anbefaler medicinen som standardbehandling til spædbørn med SMA type 1, der får behandlingen, inden de bliver seks måneder, og ikke er i permanent ventilationsbehandling i mere end 16 timer i døgnet. Anbefalingen omfatter også spædbørn, der er født med sygdommen, men endnu ikke har haft symptomer.
Behandling til ældre børn og voksne godkendt i USA
Resultaterne fra et studiet STEER med onasemnogene abeparvovec i en anden koncentration end Zolgensma, viste at stoffet også har en positiv effekt på ældre børn og voksne med SMA. Derfor har FDA godkendt onasemnogene abeparvovec til alle med SMA over to år. Medicinen bliver markedsført under navnet ITVISMA.
Forsøg med Zolgensma (onasemnogene abeparvovec), der ledte frem til godkendelsen
Stoffet onasemnogene abeparvovec er udviklet af medicinalvirksomheden Novartis, som har fundet metode til at indføre modificeret virus i det SMN-gen, der er nødvendigt for at producere SMN-protein. Stoffet gives som almindelig indsprøjtning i blodbanen og skal kun gives en gang i hele ens levetid.
I et forsøg med 15 spædbørn med SMA type 1 undersøgte man sikkerheden og virkningen af AVX-101. Der var ingen kontrolgruppe, men man brugte naturhistorien (beskrivelsen af sygdommens naturlige forløb) som sammenligningsgrundlag. Ingen af deltagerne havde brug for hjælp til vejrtrækning ved 20 måneders-alderen og man kunne måle markante fremskridt i funktionstesten. Ni ud af tolv kunne side selvstændigt i 30 sekunder, (to deltagere kom senere til at gå).
Konklusion: Forsøget viste markant forbedring i overlevelse og vejrtrækning og bedre muskelfunktion sammenlignet med naturhistorien.
De to spædbørn, der senere kom til at gå, var yngre end de andre, da de fik behandlingen, hvilket også her tyder på, at jo tidligere i livet man får behandlingen, jo bedre virker den.
Opfølgning på forsøg
Novartis har udført i tre forsøg i både USA og Europa på henholdsvis præsymptomatiske børn, børn med SMA1 under 6 måneder og børn, der har haft symptomer inden de fyldte 6 måneder. Alle studier viser at en enkelt dosis Zolgensma kan give, hvad der betegnes som en hurtig, signifikant og klinisk meningsfuld virkning for patienter med SMA. Virkningen har vist sig at holde hos børn, der fik deres dosis for fem år siden.
-
Risdiplam (Evrysdi) er godkendt som standardbehandling i Danmark
Medicinrådet anbefaler Risdiplam som standardbehandling til følgende grupper af patienter med SMA:
- børn med SMA 1, som ikke er i permanent respiratorbehandling
- personer med SMA type 2 og 3 mellem 6 og 17 år, som ikke er i permanent respiratorbehandling med trakeostomi eller anvender non-invasiv respirator i mindre end 16 timer pr. døgn/i mere end 21 dage
- personer med SMA type 2 og 3 mellem 18 og 25 år, som opfylder samme kriterier som ovenfor og visse andre funktionsmæssige kriterier
- voksne over 25 år, som opfylder Medicinrådets kriterier for opstart af behandling
Medicinrådet anbefaler ikke, at risdiplam kombineres med andre lægemidler mod SMA, da der aktuelt ikke er dokumentation for bedre effekt ved at kombinere flere behandlinger. Til gængæld er det muligt for patienter, som er i behandling med Risdiplam at skifte til behandling med Spinraza og vice versa, da effekten af de to produkter vurderes at være den samme.
Risdiplam er anbefalet som førstevalg til alle patienter, fordi prisen er lavere end Spinraza.
Forsøg med Evrysdi (Risdiplam)
Risdiplam, som markedsføres under navnet Evrysdi, er ligesom Spinraza en behandling, der modificerer det mindre effektive SMN2-backup gen. Medicinen gives som en væske gennem munden eller i pilleform. Den virker ved at få SMN2-genet til at danne mere SMN-protein for at beskytte motorneuronerne og øge muskelfunktionen.
Her beskrives resultaterne fra de forsøg, der ledte frem mod godkendelsen af Risdiplam:
FIREFISH – var et forsøg for spædbørn med SMA 1 i alderen 1-7 måneder. Alle vidste, at de fik medicinen. De foreløbige resultater af FIREFISH-studiet viste
- en forbedring af siddefunktionen hos lidt under halvdelen af deltagerne efter behandling i otte måneder
- at cirka en tredjedel havde opnået at kunne rulle om på siden
- at cirka halvdelen havde opnået at kunne sparke og holde hovedet oprejst.
Ændringer i funktionsniveau blev målt med Hammersmith-skalaen.
SUNFISH – var et forsøg med børn og unge fra 2 til 25 år med SMA 2 og 3, der sammenlignede ændring i funktion hos personer, der fik medicinen, og en kontrolgruppe, der fik placebo (ikke virksomt medicin). Resultater efter ét års behandling viste
- at deltagere, der fik medicinen, opnåede en lille, men signifikant, ændring i funktion sammenlignet med kontrolgruppen
- den største forandring blev set hos de yngste deltagere (2-5 år)
- deltagere i gruppen 18-25 år opnåede en stabilisering i funktionsevnen (dvs. hverken forværring eller forbedring) over de 12 måneder.
JEWELFISH – var et forsøg med personer i alderen 6 måneder til 60 år med SMA 2 og 3, som tidligere havde været med i andre kliniske forsøg. Alle vidste, at de fik medicinen. Et delstudie efter 12 måneder viste i lighed med andre studier,
- at medicinen var sikker
- de fulgte personer havde fordoblet deres andel af SMN-protein og havde stabil motorisk funktion
Forsøget fortsatte i yderligere 12 måneder.
RAINBOWFISH undersøgte 26 nyfødte børn, der var diagnosticeret præsymptomatisk, dvs. at de var fundet ved screening og endnu ikke havde symptomer. Resultater efter behandling i to år viste at:
- Alle børn med tre eller flere SMN2-kopier opnåede at stå og gå inden for WHO’s normale udviklingsvinduer.
- Børn med to SMN2-kopier kunne alle sidde, og de fleste kunne stå og gå selvstændigt.
- Alle børn kunne spise og synke normalt, og ingen havde brug for permanent hjælp til vejrtrækning.
- Børnenes kognitive færdigheder var på niveau med børn uden SMA, og sikkerhedsprofilen forblev god.
Screening af nyfødte
Resultaterne fra de fleste forsøg med ny medicin til SMA viser, at jo tidligere i forløbet medicinen gives, jo bedre virkning har den, og allerbedst er det, hvis medicinen kan gives præsymptomatisk, dvs. inden der opstår symptomer. I Danmark blev newborn screening indført i starten af 2023.
Hvor kan jeg finde mere information?
RCFM følger med i forskningen, men kan ikke beskrive alle de forsøg, der er i gang verden over. Hvis du ønsker et overblik over alle igangværende forsøg og forskningsprojekter, kan du besøge siden clinicaltrials.gov, hvor du kan søge på forskellige diagnoser eller præparater.
TREAT-NMD er et internationalt netværk for forskning i muskelsvind. På deres hjemmeside kan man læse om, hvad der foregå både i den førkliniske (preclinical) og kliniske forskning (clinical).
Neurologisk tidsskrift er et dansk onlinemedie, som skriver om forskning og behandling af neurologiske sygdomme, herunder muskelsvind. Det er muligt at abonnere på deres nyhedsbrev. Her kan du læse et temanummer om genterapi, som bl.a. handler om medicin til SMA.