Hvorfor tager det så lang tid?
Forskning i medicin – fra mus til mennesker
Der forskes som aldrig før for at finde medicin, der kan helbrede eller mindske symptomerne på muskelsvind, og der er virkelig sket mange fremskridt de seneste år. I dag (2019) behandler man fx Duchennes muskeldystrofi med binyrebarkhormon, spinal muskelatrofi med Spinraza, myasthenia gravis med Mestinon og Pompes sygdom med Myozone.
Medicin til sjældne sygdomme
Udviklingen af medicin falder i to dele: De førkliniske undersøgelser og de kliniske undersøgelser.
De førkliniske undersøgelser foregår i et laboratorium og omfatter kemiske forsøg, afprøvninger på celleniveau og som regel også dyreforsøg (fx på mus). Ved de kliniske undersøgelser afprøver man det udviklede medikament på mennesker.
Ved sjældne sygdomme er der kun udsigt til at kunne sælge en mindre mængde medicin, mens udviklingsomkostningerne kan være lige så store som ved at lave medicin til store befolkningsgrupper. Dermed er medicinalvirksomhedens mulighed for at tjene penge på medicinen dårlig og incitamentet til at lave sjælden medicin begrænset.
For at rette op på denne situation har man i USA og i EU lavet særlige regler for udviklingen af medicin til meget sjældne sygdomme. De kaldes ”orphan drugs” og man støtter produktionen af dem ved at give de medicinalfirmaer, der arbejder med dem nogle fordele frem for, hvad der ellers er normalt ved udvikling af ny medicin. Det drejer sig blandt andet om skattefordele, lempeligere vilkår vedrørende tidsfrister og hurtigere sagsbehandling ved ansøgning om fx markedsføringstilladelse.
Hvis den nye medicin skal gives mod meget alvorlige sygdomme, hvor der ikke allerede findes en virksom medicin, og hvor sygdommen medfører døden eller meget alvorlige symptomer, kan myndighederne (i EU og USA) give en såkaldt ”Fast Track” tilladelse, der ligesom ”orphan drug” tilladelsen gør det muligt at udvikle den nye medicin hurtigere og billigere.
Førkliniske undersøgelser
Er det sikkert? Har det en effekt? Kan det bevæge sig til den del af kroppen, der har brug for det? Er det stabilt? Hvad sker der med medikamentet, når det bliver nedbrudt? Bliver det til noget giftigt? Hvordan reagerer kroppen, når den får medikamentet?
Disse spørgsmål bliver stillet og besvaret igen og igen, om de substanser forskerne udvikler med det mål, at det kan blive til medicin. For hver runde spørgsmål og svar prøver man at gøre medikamentet bedre og starter så forfra med undersøgelserne, til man til sidst står med et, måske flere, lovende medikamenter.
Næste skridt er at afklare hvilken metode til at give medikamentet til mennesker, der er den bedste. Man kan tage en pille, give medikamentet intravenøst ved indsprøjtning direkte i den eller de muskler, man vil behandle. Man skal også forsøge at finde ud af, i hvor store doser medicinen skal gives for at have en effekt.
Det er også vigtigt, at afklare om man kan fremstille medicinen, så den er helt ens ved hver produktionsrunde. Og man skal finde ud af, om man kan lave medicinen i store nok portioner, til at de kan opfylde behovene hos patienterne. Nogle medikamenter er enkle at lave, mens andre, fx biologiske medikamenter, er meget komplicerede og tilsvarende vanskelige og kostbare at fremstille.
På baggrund af resultaterne fra den førkliniske undersøgelse kan man søge myndighederne om tilladelse til at afprøve medikamentet på mennesker i den kliniske undersøgelse.
Kliniske undersøgelser
Ved de kliniske undersøgelser bliver medikamentet for første gang afprøvet på mennesker. Ligesom ved de førkliniske undersøgelser er målet at afklare, i hvor store doser præparatet skal gives til, at der er en behandlingsmæssig effekt og færrest mulig bivirkninger. Det skal også afklares, hvordan man skal give medicinen og hvor ofte. Det er mange af de samme spørgsmål, man stillede i de førkliniske undersøgelser, men der er en afgørende forskel på at undersøge laboratoriemus og på at undersøge mennesker.
Der er ofte mange, der gerne vil deltage som forsøgsperson i et håb om, at de kan afprøve en behandling, der har en god effekt. Men målet med den kliniske undersøgelse er ikke at behandle. Er man forsøgsperson i et forskningsprojekt, kan man risikere, at det medikament man undersøger, ikke har en gunstig effekt. Der er også en mulighed for, at man som forsøgsperson deltager i undersøgelsen ved at få placebo (snydemedicin). Og hvis man får et virksomt præparat, er der ingen sikkerhed for, at man kan fortsætte med at få det, efter forsøget er slut.
Faserne
Inden man kan ansøge om at få et præparat godkendt, skal det igennem mindst tre testfaser.
I fase 0 gennemføres de første forsøg på mennesker. Man giver kun medikamentet i meget små doser – langt under, hvad man tror, kan have en effekt. Kun 10-15 personer uden sygdom deltager i denne fase, der først og fremmest handler om at fastslå, hvor sikkert præparatet er, og hvordan det absorberes, fordeler sig, omsættes og nedbrydes i kroppen.
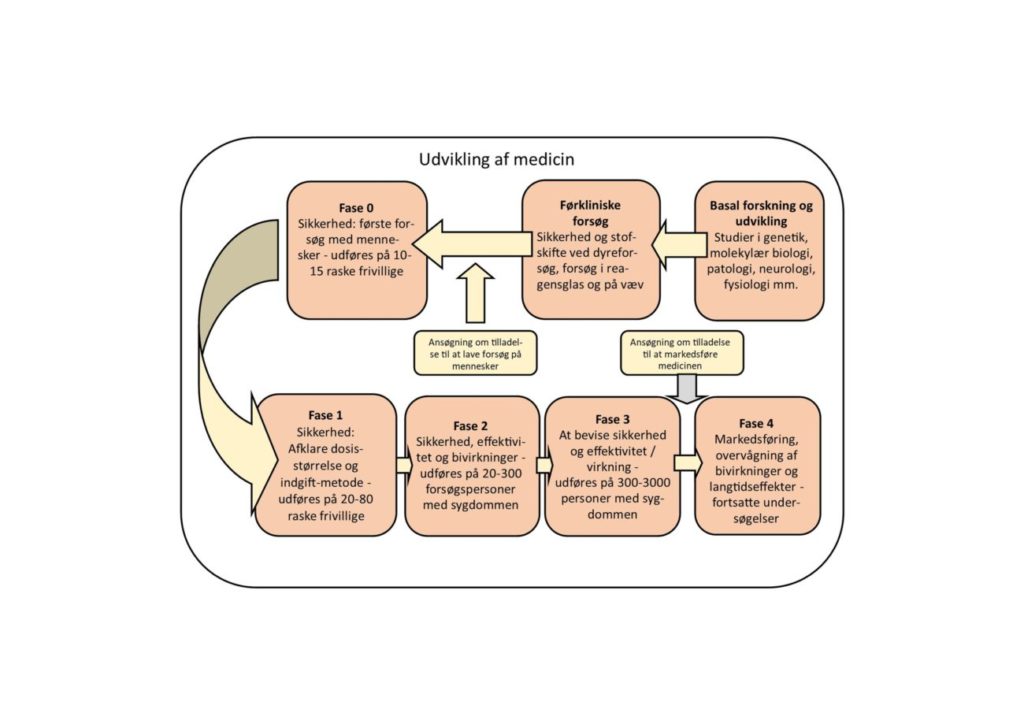
I fase 1 undersøger man på en lille gruppe mennesker (20-80), hvor store doser det kan være sikkert at give forsøgspersoner, og man begynder at vurdere bivirkningerne.
I fase 2 prøver man for første gang at give medikamentet til mennesker, der har den sygdom, man vil behandle. Man undersøger en middelstor gruppe personer (20-300) for at se, hvor effektivt medikamentet er til at behandle sygdommen, og om effekten afhænger af dosernes størrelse eller den måde, de gives på. Også i fase 2 er der stor fokus på bivirkningerne.
I fase 3 undersøger man på en meget stor gruppe personer med den sygdom, man vil behandle (300-3000), hvordan medikamentet virker som behandling, og hvilke bivirkninger det har. Det store antal forsøgspersoner betyder, at det er meget omfattende at gennemføre denne fase.
Muskelsvind er sjældne sygdomme, og det er kun store lande, der selv kan finde det store antal forsøgspersoner, der er brug for i fase 2 og fase 3. Derfor er det almindeligt, at forskellige forskningscentre over hele verden samarbejder om at afprøve medicinen.
I fase 2 og fase 3 gennemføres undersøgelserne ofte ved, at man inddeler forsøgspersonerne i flere forskellige grupper. I nogle grupper får forsøgspersonerne en dosis forsøgsmedicin, i en anden gruppe, en anden dosis, og som regel er der også en gruppe, der får uvirksom medicin, det såkaldte placebo. Mens forsøget foregår, ved hverken forskere eller forsøgspersoner, hvem der får hvad. Det opgøres først til sidst. Forsøgspersonerne bliver jævnligt undersøgt for ændringer i deres tilstand.
Bivirkningerne vurderer man løbende, og hvis de er for voldsomme eller for mange, kan en forsøgsperson trække sig, eller forsøget kan standses.
Ved afslutningen af forsøget må man vurdere, om der er et fornuftigt forhold mellem virkninger og bivirkninger. Hvis resultaterne har være gode og bivirkningerne små, er der basis for at søge myndighederne om tilladelse til at markedsføre den nye medicin.
Efter medicinen er blevet markedsført, bliver man ved med at undersøge langtidsvirkningerne og bivirkningerne. Dette forløb omtales som fase 4.
RCFM’s bidrag til forskningen
Vigtigt at kende naturhistorien
Før man kan gå videre med forsøgene, er man nødt til så detaljeret som muligt at vide, hvordan den naturlige udvikling for en person med den aktuelle sygdom er. Man må vide, hvordan den ubehandlede sygdom forløber, før man kan se om medikamentet medfører en forskel.
Selv om RCFM ikke deltager i udviklingen af medicin, kan vi bl.a. bidrage til processen ved at beskrive naturhistorien, fortæller fysioterapeut, ph.d. Ulla Werlauff fra RCFM’s forsknings- og udviklingscenter (FU).
Udvikling af målemetoder
Derudover har FU løbende deltaget i arbejdet med udvikling af målemetoder, fortæller Ulla Werlauff. Fx blev EK skalaen til klassifikation af funktionsevne ved Duchennes muskeldystrofi (DMD) udviklet af Birgit Steffensen fra UC. EK skalaen har fået stor international anerkendelse. For øjeblikket medvirker UC i et internationalt projekt, der skal udvikle et måleredskab for armfunktion hos mennesker med DMD, siger Ulla Werlauff.